Hinweis: Dieser Artikel ist ein Beitrag zum ScienceBlogs Blog-Schreibwettbewerb 2016. Hinweise zum Ablauf des Bewerbs und wie ihr dabei Abstimmen könnt findet ihr hier.

Das sagt der Autor des Artikels, Isaak Unger über sich:
Isaak Unger hat in Berlin Physik studiert und hat anschließend am Helmholtz-Zentrum Berlin / der FU Berlin promoviert (und wartet im Moment auf die Promotionsurkunde). Zur Zeit arbeitet er an der Universität Uppsala in Schweden. Er versucht sich hier im Schreiben eines Blogs mit der Hoffnung der Allgemeinheit etwas für die in seine Forschung investierten Gelder zurückzugeben und die eine oder den anderen für die Komplexität kleiner Moleküle in Lösung zu begeistern.
——————————————
Der Titel klingt nach Esoterik und Homöopathie? Einhörnern und Yetis? Da ist was dran, aber dass dies nur eine Frage der überspitzten Formulierung ist, hoffe ich euch im Folgenden näher bringen zu können. Überhaupt hoffe ich euch für Wasser auch auf der molekularen Ebene ein wenig interessieren zu können. Ob mir das gelingt? – Mal sehen. Wahrscheinlich macht man sich im Alltag nicht so häufig Gedanken über Wasser: Wasserhahn aufdrehen – da ist es! Wann wird man auch bewusst mit dem Thema Wasser konfrontiert? Beim Wassersparen, Wassermangel, saurem Regen und wenn man den Regenschirm zu Hause vergessen hat. Das sind aber alles Themen, die sich um den Wasserhaushalt drehen und man sollte annehmen, dass so ein kleines, allgemein bekanntes und allgegenwärtiges Molekül keine großen Überraschungen mehr bergen sollte. Wasser ist regelrecht langweilig. Dachte ich. Dann begann ich mich aus der Perspektive eines Festkörperphysikers dem Thema zu nähern und natürlich war auf einmal garnichts mehr einfach. Mehr noch: Ich musste feststellen, dass unser altes, allgegenwärtiges und langweiliges Wasser auf vielen Ebenen seher schlecht verstanden ist und viele Anomalien birgt. Die wohl bekannteste ist, dass es sich beim frieren ausdehnt, anstatt sein Volumen weiter zu verringern. Die meisten werden sich noch daran erinnern, dass man geschlossene und gefüllte Wasserflaschen besser nicht zu lange im Gefrierschrank lässt.
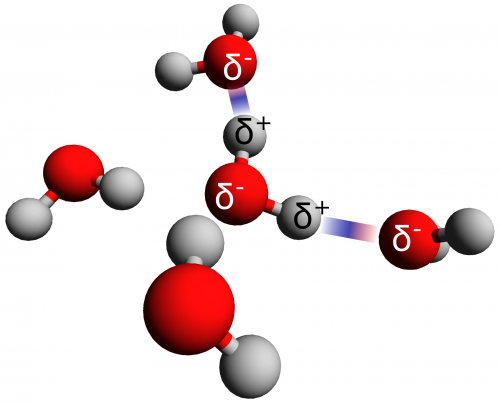
Die Volumenvergrößerung beim Frieren ist aber nur eine der vielen Anomalien dieses kleinen Moleküls und bis dato ist noch kein umfassendes Modell entwickelt worden, das all diese Anomalien befriedigend erklärt. Allein schon die Anordnung der Moleküle in normalem, flüssigem Wasser ist unter einigen Wissenschaftlern umstritten. Das vorherrschende Modell geht davon aus, dass jedes Wassermolekül von vier anderen Wassermolekülen umgeben ist, die an den Ecken eines Tetraeders angeordnet sind. Zu jedem Nachbarmolekül wird eine Wasserstoffbrückenbindung aufgebaut (wie ich im Bild versucht habe zu skizzieren). (Wasserstoffbrückenbingung? Was war das nochmal? In der Box habe ich es versucht zu umreißen.
Wasserstoffbrückenbindungen sind Bindungen zwischen Molekülen, die an verschiedenen Stellen unterschiedlich partiell geladen sind (symbolisiert mit δ+ bzw. δ–). Im Beispiel ‚Wasser‘ führt der unterschiedliche Elektronegativitätswert der Sauerstoff- und Wasserstoffatome zur Ausbildung der Partialladungen. Der Elektronegativitätswert gibt dabei, vereinfacht, die Fähigkeit eines Atoms an in einer chemischen Bindung die Elektronen ‚an sich zu ziehen‘. Der Elektronegativitätswert von Sauerstoff ist höher, als der von Wasserstoff, so dass das Sauerstoffatom die Elektronen ‚an sich zieht‘ und dadurch partiell negativ geladen wird; die Wasserstoffatome werden entsprechend partiell positiv geladen. Kommen sich zwei Wassermoleküle nahe, so richten sie sich entsprechend dieser intramolekularen Partialladungen zueinander aus. Das läuft darauf hinaus, dass ein Wasserstoffatom eines Moleküls zum Sauerstoffatom des Nachbarmoleküls zeigt. Die daraus resultierende Anziehung zwischen dem ‚positiv geladenen Ende‘ des einen Wassermoleküls und dem ’negativ geladenen Ende‘ des Nachbarmoleküls ist die Wasserstoffbrückenbindung.
Häufig wird davon gesprochen, dass viele Wassermoleküle ein Wasserstoffbrücken-Netzwerk aufbauen. Im Wesentlichen entspricht diese Struktur der von Eis. Das mag sich jetzt etwas verwunderlich anhören, schließlich entsprechen Eis und flüssiges Wasser zwei verschiedenen Aggregatzuständen. Der Unterschied zwischen flüssigem Wasser und Eis liegt in der Dynamik des Wasserstoffbrücken-Netzwerks. In flüssigem Wasser brechen die Wasserstoffbrückenbindungen sehr häufig auf, ein Wassermolekül rotiert und sucht sich einen anderen Bindungspartner für die Ausprägung einer neuen Wasserstoffbrückenbindung. Dieser Prozess dauert ca. 2,3 Picosekunden (billionstel Sekunden) und beeinflusst weitere Wassermoleküle in der näheren Umgebung, die ebenfalls Bindungen auflösen, rotieren und neue Wasserstoffbrückenbindungen aufbauen (schließlich hätten wir sonst ein Wassermolekül mit fünf und eins mit nur drei Bindungspartnern). In dieser stetigen Fluktuation des Wasserstoffbücken-Netzwerks liegt begründet, weshalb Wasser fließt und Eis dies bestenfalls sehr langsam tut (denkt man z.B. an Gletscher).
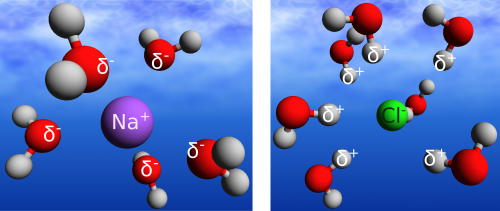
Die Dynamik des Wasserstoffbrücken-Netzwerks kann durch Fremdkörper im Wasser beeinflusst werden. Fremdkörper, das können schon einfache Ionen sein, wie zum Beispiel Natrium- und Chlorid-Ionen nach dem Auflösen von Kochsalz. In dieser Salzlösung befinden sich dann negativ geladene Chlorid-Ionen (Cl–(aq)) und positiv geladene Natrium-Ionen (Na+(aq)). Das ‚(aq)‘ gibt dabei an, dass es sich um Ionen in wässriger Lösung handelt, die Ionen also von Wassermolekülen umgeben sind. Um Natrium-Ionen und Chlorid-Ionen ordnen sich je 5 bzw. 7 Wassermoleküle an, wie im Bild dargestellt – diese Wassermoleküle bilden die sogenannte erste Solvatschale um das Ion. Je nach Größe des Fremdmoleküls im Wasser kann die erste Solvatschale mehr oder weniger Wassermoleküle umfassen – so beinhaltet die erste Solvatschale von großen Biomolekülen wie Proteinen, die selbst hunderte von Atomen beinhalten können auch entsprechend mehr Wassermoleküle.
Aber zurück zur Kochsalzlösung und warum muss man die Wassermoleküle um ein Ion überhaupt speziell mit ‚Solvatschale‘ bezeichnen? Es sind doch immernoch einfach nur Wassermoleküle! In der Tat – Wassermolekül ist Wassermolekül, aber die Dynamik zwischen den Wassermolekülen in einer Solvatschale und Wassermolekülen im bulk-Wasser unterscheidet sich. (bulk-Wasser bezeichnet an dieser Stelle reines Wasser, das weit genug von allen Grenzflächen, wie z.B. Gefäßwänden entfernt ist. Leider scheint es im Deutschen keine kurze und sinnvolle Übersetzung dieses Begriffs zu geben.) Betrachten wir zuerst die Wassermoleküle um ein positiv geladenes Natrium-Ion.
Die Wassermoleküle richten sich entsprechend ihrer Partialladung mit dem Sauerstoffatom zum Ion aus, während die Wasserstoffatome vom Ion wegzeigen und Wasserstoffbrückenbindungen bilden können. Beim negativ geladenen Chlorid-Ion ist es umgekehrt: Eines der Wasserstoffatome richtet sich zum Chlorid-Ion aus, während das Sauerstoff-Atom vom Ion wegzeigt. Das zweite Wasserstoffatom wird für die Bildung von Wasserstoffbrückenbindungen mit anderen Wassermolekülen in der Umgebung benutzt. Man kann sich vorstellen, dass auf diese Weise ‚fixierte‘ Wassermoleküle nicht mehr gleich schnell rotieren und neue Bindungen ausbilden, wie Wassermoleküle im bulk-Wasser. Dieses Bild der ‚fixierten Wassermoleküle‘ um ein Ion ist genau das, was die Gruppe um Huib Bakker in den Niederlanden durch Messungen untermauert hat. Die Wissenschaftler untersuchten die ‚Steifigkeit‘ des Wasserstoffbrücken-Netzwerks im bulk-Wasser und in der Umgebung von Ionen. Das Ergebnis ist eine um mehr als den Faktor zwei verlangsamte Dynamik der Wassermoleküle um ein Anion (im obigen Beispiel wäre dies das Chlorid-Ion, in der Studie waren es Perchlorat-Ionen: ClO4–(aq)). Des Weiteren schätzten die Wissenschaftler die Menge der Wassermoleküle ab, die von der Anwesenheit der Ionen beeinflusst werden, mit dem Ergebnis, dass lediglich Wassermoleküle in der ersten Solvatschale eine verlangsamte Dynamik aufweisen.
Gut, also wissen wir jetzt, dass Wassermoleküle um Ionen und Fremdmoleküle eine andere Dynamik aufweisen, als Moleküle bulk-Wasser. Was erklärt uns das nun? Ich habe zwei Gründe im Angebot, warum man dieses Wissen zumindest spannend vielleicht sogar nützlich finden kann – ein Grund entspringt eher der Neugier, der andere ist etwas anwendungsorientierter.
Mit dem oben angesprochenen Konzept der Dynamik von Wassermolekülen in der Solvatschale kann man sich auf molekularer Ebene erklären, warum z.B. sehr hoch konzentrierte Salzlösungen wesentlich viskoser sind als reines Wasser. Bei hohen Konzentrationen befinden sich fast alle Wassermoleküle in der Solvatschale von Ionen und entsprechend ist die Dynamik des Aufbrechens und Neuformierens von Wasserstoffbrückenbindungen zwischen den Wassermolekülen verlangsamt und damit auch das Fließverhalten der Lösung. Zumindest ich finde es faszenierend und irgendwie befriedigend mir eine mit bloßen Augen beobachtbare Größe auf der molekularen Ebene erklären zu können.
Der zweite Grund ist etwas abstrakter, aber vielleicht weniger von Neugier, als von Nutzen getrieben. Mit dem Wissen um die veränderte Dynamik von Wassermolekülen in der Nähe von Fremdkörpern verstehen wir wesentlich besser, welche Rolle Wasser bei chemischen Reaktionen an Enzymen spielt. Enzyme sind in der Regel Proteine, die im Körper ganz bestimmte chemische Reaktionen sehr effizient ablaufen lassen, sie operieren als Katalysatoren. Allerdings wirkt nicht die gesamte Oberfäche des Proteins als Katalysator, sondern nur ein kleiner Bereich, der zudem noch in einer Art ‚Tasche‘ in der Struktur des Proteins verborgen sein kann. Um die erwünschte chemische Reaktion am Protein ablaufen zu lassen, müssen zuerst die Ausgangsstoffe zur entsprechenden Stelle des Proteins transportiert werden. Im Anschluss müssen die Reaktionsprodukte auch wieder abtransportiert werden, bevor ein weiteres Ausgangmolekül umgesetzt werden kann. Diese Transportprozesse finden alle in wässriger Lösung statt und entsprechend bestimmt die Dynamik der Wassermoleküle um das Protein und um die Ausgangsstoffe / Reaktionsprodukte mit über die Geschwindigkeit der chemischen Reaktion. Je schneller die Dynamik der Wassermoleküle in der entsprechenden Region ist, um so schneller der Stofftransport. Wollen wir also Reaktionen in wässriger Lösung durch Katalyse effizienter gestalten, sollten wir im Auge behalten, wie der Katalysator strukturiert ist und wie sich das auf die Solvatschale auswirkt. Ich behaupte nicht, dass dieses Wissen aktuell schon viel Anwendung findet, aber es ist ein Thema, das vor allem in Simulationen zur Zeit Aufmerksamkeit genießt.
Von diesem Exkurs zurück in die ‚Wirklichkeit‘ zu unserem Kochtopf voll Salzwasser. Ich hoffe euch zwei Dinge näher gebracht zu haben: Einmal, dass das langweilige, kleine Moleküle aus dem wir größtenteils bestehen noch sehr viele ungelöste Fragen aufwirft und zweitens, dass jeder zu Hause die Dynamik von (einigen) Wassermolekülen mit einer Prise Salz beeinflussen kann.
Wen das Thema interessiert (und wer Zugang zu den Fachartikeln hat), kann in den folgenden beiden Fachartikeln mehr erfahren:
‚Analysis of Water in Confined Geometries and at Interfaces‘, M. D. Fayer & N. E. Levinger, Annual Review of Analytical Chemistry 3, 89 (2010)
‚Negligible Effect of Ions on the Hydrogen-Bond Structure in Liquid Water‘, A. M. Omta, M. F. Kropman, S. Woutersen, H. J. Bakker, Science 301, 347 (2003)
ein netter artikel über ein wenig bekanntes phänomen, danke dafür.
die illustrationen finde ich ausgezeichnet – schade, dass die fehlgeschlagene formatierung den lesefluss etwas beeinträchtigt – verlangsamt sozusagen.
(auch prof. L. hat einen netten beitrag bei alpha c. folge 107 – ist wasser magisch?)
offensichtlich 🙂
H2O ist eines der lebenswichtigsten Stoffe auf diesem Planeten, hier sollte wirklich jedermann darüber Bescheid wissen,… ein guter Einstieg. 🙂
Ergänzende Links zum Thema H2O:
Die schwebende Wasserbrücke
Water Structure and Science
Ohne Wasser kein Leben. Das sollte man sich immer wieder bewusst machen.
Wasser ist unglaublich interessant und der Beitrag ist gut geschrieben, weckt Lust auf mehr. Wie und warum wirkt sich das Salz nun auf den Siede- und Gefrierpunkt aus? Welche Rückschlüsse erlaubt dies nun auf die Dichteanomalie und die Oberflächenspannung?
Fragen über Fragen die den Beitrag wohl gesprengt hätten.
@Vortex
Ja, warum bildet das Wasser „schwebende Wasserbrücken“? Nun, die Moleküle ordnen sich gemäß dem Feld an und alle richten sich gleich aus.
Könnte man ja nutzen. Wenn man um die Kaffeetasse herum ein drehendes Magnetfeld installiert, spart man sich das Umrühren.
@Artur57
Ein kleiner Versuch könnte den Hinweis dazu liefern, man läßt beim Wasserhahn einen feinen Wasserstrahl herunterfließen und nähert sich dem Strahl mit einem Supermagneten,… was passiert, wird der Wasserstrahl abgelenkt?,… nein, leider nicht!
Das gleiche, versuchen wir mit einem elektrostatischen Feld und sofort sehen wir eindeutig eine Ablenkung des Wasserstrahls, also bräuchten wir ein rotierendes elektrostatische Feld um die Kaffeetasse herum, dann würde es vmtl. klappen, mit dem Umrühren ohne Löffel. 😉
Ein weiterer interessanter Versuch wäre, wenn man das Wasser bei Raumtemperatur über ein geometrisch exakt abgestimmtes Hochspannungsfeld in einen molekular-kristallinen Zustand versetzen könnte, also analog zur Wasserbrücke, nur in größeren Dimensionen.
Hierfür würde ich ein geometrisch variables elektrostatische Feld verwenden, welches die innere Struktur der Wassermoleküle unterstützt und bei einer tatsächlichen Stabilisierung der Wasserstoffbrückenbindung für einen viel längeren Zeitraum als nur zw. 1 bis 20 ps (Picosekunde), solches vielleicht sogar als zukünftiger Quantencomputer geeignet wäre.
Dann müßte vmtl. nur ein 3D-Netzwerk aus Wassermolekülen in Kombination mit einem geeigneten laseraktiven Farbstoffmolekül diese funktional angedockt werden, wie z.B. Rodamin (rot) oder Natriumglutamat (blau), welches beide mittels eines UV-Laser aktiviert und in Echtzeit gescannt werden könnte,
… na ja nur mal so eine Idee, jedenfalls sollte sich diese Struktur analog zum Kristallwachstum, ganz wie von selbst aufbauen. 🙂
Korrektur zu #7
Die richtige Schreibweise und der als Tracer geeignete Farbstoff ist hier Rhodamin B
evtl. als H2O – Ethanol Mischung?
Erstmal vielen Dank für die Kommentare – ich war die vergangene Woche nicht im Lande und daher etwas still. Ok, der Reihe nach:
Zur Formatierung: Da gab es ein kleines Kommunikationsproblem. Ich habe nochmal nachgearbeitet und Florian gebeten die entsprechenden Textstellen zu übernehmen. Hoffentlich wird es dann zumindest lesbar…
Zu den Wasserbrücken – dieses Phänomens war mir noch nicht bewusst, obwohl es ja schon lange bekannt ist. Allerdings legt man wohl auch nicht jeden Tag Hochspannung an destilliertes Wasser. 😉 Auf jeden Fall mehr Lesestoff über das ‚langweilige Molekül‘ für mich. Danke!
@Vortex Artur57: Na ja, Magnetrührer gibt es schon in jedem Labor. Aber wenn man eine Metalltasse nimmt, könnte man den Kaffee via Induktion auch warm halten!
———————————-
Zum Farbstoffversuch von Vortex: Vielleicht verstehe ich das hier falsch, aber die Wassermoleküle um die Farbstoffe würden sich wohl anders verhalten, als ‚bulk‘-Wassermoleküle. Wenn man sich mal die Struktur von Rhodamin B ansieht, dann hat man mehrere hydrophile und hydrophobe Gruppen. Je nach dem, an welcher Stelle in der Solvatschale um das Farbstoffmolekül sich ein Wassermolekül befindet, wiese es eine unterschiedliche Dynamik auf. Während das bei hydrophilen Gruppen wie im Blog erklärt läuft (Ausrichtung der Dipole), ist das in der Nähe der hydrophoben Gruppen (delokalisiertes pi-Elektronensystem im Beispiel Rhodamin Bs) anders. Hier kann auf einer Seite kein entsprechender Bindungspartner für das Formen einer H-Brücke gefunden werden (da ist die ‚hydrophobe Wand‘ der Moleküls), was die Dynamik auch verändert -> nicht alle Rotationen führen zu einer Verringerung der Energie. Ergo: Ich wäre nicht sicher, ob man nicht eher den Einfluss des Farbstoffs auf das Wasser misst, als anders herum. Oder, wenn die elektrischen Felder stark genug sind, dass die Wassermoleküle einfach von den Farbstoffmolekülen ‚entkoppeln‘, weil das äußere Feld zu stark ist. Auf der anderen Seite habe ich noch nicht mit Farbstoffmarkern gearbeitet und habe – bestenfalls – eine ganz grobe Idee, wie das funktioniert. Mir ist z.B. nicht ganz klar, wie das Floureszenz-Signal der Farbstoffe an die Kristallstruktur koppeln soll.
Was aber die Struktur von Wasser angeht – da gibt es Möglichkeiten das zu testen – auch ohne Zugabe von Farbstoffen. Im oben angesprochen Beispiel von Bakker und Kollegen wurde ein Infrarot-Laser benutzt. Man mischt dann Wasser und teils deuteriertes Wasser (HDO). An Hand der Absorption Infrarotlichts kann man unterscheiden, ob ein H-Atom oder ein Deuterium-Atom entlang einer Bindung schwingt. Deuterium schwingt auf Grund seiner höheren Masse etwas langsamer und absorbiert Licht einer anderen Wellenlänge.
Darüber hinaus kann man z.B. Röntgenstrahlung der richtigen Wellenlänge an Kristallgittern (oder am H-Brücken-Netzwerk von Wasser) streuen und Bindungsabstände etc. herausbekommen.
Sowohl für Infrarot als auch für Röntgenstrahlung gibt es Lichtquellen, die ausreichend kurze Lichtpulse liefern.
… Wasser ist nicht nur zum Waschen da – jeder Tropfen hohlt den Stein. Wasser hat ein Gedächtnis. Es gibt weiches und hartes Wasser – Waschmaschine bittet um kalkon. Unsere Erde hat mehr Wasser als festes Land – ohne Wasser sieht unsre Erde wie eine Kartoffel aus. Jesus konnte über Wasser gehen und Moses war Mehrteiler
Wasser Marsch sagt die Feuerwehr – und Wasserstoff Autos sind modern und Umweltengel – was rein kommt kommt rein raus.
Auf dem Mond blühen keine Rosen weil es kein Wasser gibt … darum bleib ich hier …
Wasser ist LEBEN.
Was Wasser noch kann – doch selbst erforschen – Interessant – biotec4u
@Isaak Unger / #9
Man darf es ruhig als Brainstorming eines interessierten Laien bezeichnen. 😉
Mit einem ähnlichen selbstgebauten Stickstofflaser hatte mal ein Bekannter mit Rhodamin B und Natriumglutamat herumexperimentiert, daran hatte ich mich erinnert und spontan die Idee für einen möglichen Quantencomputer mittels Wassermolekülen + eingebetteter Farbstoffmatrix hier eingebracht, nur die wahre Physik/Chemie schaut halt anders aus.
Die ursprüngliche Idee: Ein molekular-kristalliner Quantencomputer aus H2O-Molekülen, welches mittels eines elektrostatischen Feldes bei Raumtemperatur generiert wird.
Ideenquelle [PDF]: Elektrostatische Wechselwirkungen in komplexen Flüssigkeiten und ihre Beschreibung mit Molekulardynamiksimulationen
Analog zu [PDF / Abbildung 1.4] sollten sich die Farbmoleküle idealerweise anordnen, mit jeweils tausenden von H2O-Molekülen zwischen den Farbmolekülen, deren räumliche Schwingungen sich durch die umliegenden H2O-Moleküle ergeben würde.
Die räumliche Ordnung der Farbmoleküle müßte sich durch die unterschiedliche Dielektrizität und Ladungen der Farb- und H2O-Moleküle, sich eigentlich selbst auf Abstand halten, solange ein elektrostatisches Feld auf das Gesamtsystem anliegt.
Idealerweise müßte das Farbmolekül kugelförmig sein, was bei Rhodamin B und auch bei Natriumglutamat leider nicht der Fall ist!
Der interessante Vorschlag, Deuterium (anstatt eines Farbstoffes) einzusetzen klingt sogar vielversprechender, da die Auflösung der räumlichen Schwingungen dann vmtl. wesentlich genauer wäre, nur wie weit jedes einzelne H2O/D2O-Molekül, auch in deren räumlichen Tiefe erfasst werden könnte, dies müßte erst in der Praxis geprüft werden.
Meine ursprüngliche Idee: z.B. ein Wasser-Kubus mit einer Kantenlänge von 1 cm wäre bereits unmöglich mit den derzeitigen technologischen Möglichkeiten, hier wirklich jedes einzelne H2O-Molekül in Echtzeit zu detektieren, deshalb der Umweg über die Farbmoleküle.
Neue Idee laut Vorschlag: Beispiel einer Ladungsverteilung unter [PDF / Abbildung 1.12], diese reicht bei einer Punktladung im Nahbereich von 10 Å bis max. 24 Å , jedoch bei meiner nachfolgenden Sandwich-Anordnung könnte man die Reichweite ohne chaotische H2O/D2O-Clusterbildung, vmtl. wesentlich erhöhen und somit eine strenge Ordnung der Wassermoleküle erzwingen.
Daher wäre ein flacher Aufbau sinnvoller, z.B. mit 2 x 2 cm Kantenlänge und mit weniger als 1 mm innere Dicke der flüssigen H2O/D2O-Mischung, wobei die zwei durchsichtigen Elektroden gegen die flüssige Mischung elektrisch Isoliert wäre, wodurch es vmtl. zu keinem Stromfluß kommen wird, nur eine exakte Polarisierung der Wassermoleküle wird hier angestrebt.
Da das elektrische Feld jetzt planparallel anliegt können lineare Bindungen mit einem Bindungswinkel von 180°, oder ein rein tetraedrisches Netzwerk (Bindungswinkel 180°) welches zu den jeweils 4 nächsten Molekülen führt, den Aufbau einer räumlichen Wasser-Matrix erleichtern.
Nur ist die Dielektrizitätskonstante bei 20° C von H2O = 80.4 und von D2O = 80.5 , so wird es vmtl. schwierig werden sie über ein Hochspannungsfeld als Matrix anzuordnen.
Eine spezielle laserprogrammierbare Elektronenemittierende Schicht, sorgt hier für die notwendige Nahfeld-Quanten-Informierung der Wassermoleküle, also im Idealfall. 🙂
Möglicher Aufbau eines flüssigen H2O/D2O-Qantencomputers bei Raumtemperatur
____________________
____________________ Durchsichtige Elektrode, Hochspannung, z.B. +/- 1000 V
:::::::::::::::::::::::::::::::::::::::: Laser-Elektronen-Matrix, UV-Laser strahlt Informationen ein!
…………………………….
……………………………. H2O/D2O – Molekülebenen als selbststrukt., räumliche Matrix
…………………………….
– – – – – – – – – – – – – Holographischer Detektor, od. Laser scannt die Molekül-Ebenen
____________________
____________________ Durchsichtige Elektrode, Gegenpol, elektrische Erdung
_______________________________________________________________________
Anmerkung: Wie schon vermutet, ist das ganze nur eine spielerische Idee von mir, falls irgend etwas davon verwertbar wäre, steht es Jedermann frei es nach belieben zu verwenden. 🙂
Mal so ganz nebenbei zum Thema Wassersparen: Damit erinnert ihr euch immer 😉
Ich frage mich gerade, ob man eigentlich D2O von HTO unterscheiden kann, abgesehen vom Messen der Radioaktivät (durch Zerfall des Tritiums) selbstverständlich? Oder D2O von H2O mit einem O-18-Atom anstatt des üblichen O-16? Ziemlich genau gleichschwer müsste auch HDO mit einem O-17 sein.
@Vortex: Oha, das ist viel zu lesen und nachzudenken. Ok, damit befasse ich mich jetzt nicht sofort, sondern wenn ich etwas Muse habe. Danke für den Beitrag auf jeden Fall. Darauf nehme ich auf jeden Fall nochmal Bezug! Freut mich, dass jemand anderes Feuer gefangen zu haben scheint. 😉
@Captain E.: Ja, das kann man unterscheiden. Einmal, wie in meinem vorherigen Post erwähnt, mittels Infrarot-Spektroskopie. Da H, D und T verschiedene Massen haben, sind die entsprechenden Schwingungsfrequenzen im den Molekülen verschieden und damit auch das entsprechende Signal in der Infrarotabsorption. Zum Beispiel die O-H Streckschwingung, in der sich der Wasserstoff vom O entfernt und wieder zurückschwingt usw.
Außerdem kann man die Kernspinresonanz (NMR) benutzen, um zwischen Isotopen unterscheiden. Das wird von Chemikern auch exzessiv genutzt. Findige Chemiker können so z.B. bestimmte Stellen eines großen Moleküls ‚isotopenmarkieren‘ und dann per NMR-Spektroskopie ganz bestimmte Atome (die markierten eben) in den Spektren herauspicken und etwas über die entsprechenden Bindungen erfahren. Dazu muss man natürlich das entsprechende Isotop gezielt an der gewünschten Stelle einbringen, was aber machbar ist, wenn man für einen Reaktionsschritt eben nur O-17 statt O-16 zur Verfügung stellt, um beim Beispiel zu bleiben.
Die entsprechenden Isotope, oder bestimmte bereits isotopenmarkierte Moleküle kann man kaufen… ist aber verteufelt teuer. Ich habe mal eben schnell nachgeguckt, um ein Beispiel zu finden. Ein Liter O-18-gas (also gasförmiger Sauerstoff) kostet ca. 1000 €. Ein Liter Gas… das ist nicht viel, wie man sich vorstellen kann.
Hmm, komisch mein Kommentar steckt immer noch in der Moderation? Ich hatte vor einer Woche einen recht länglichen Kommentar verfasst, der bisher immer noch nicht erschienen ist. Nochmal abschicken konnte ich ihn nicht, weil er wohl noch ‚im Äther‘ war. Ich hake da mal nach…
@Isaak Unger
Bei längeren Texten kommt dies schon öfters vor, vor allem wenn mehr als 2 Links darin vorkommen!
Um den geschriebenen Text nicht zu verlieren, ist es ratsam zunächst in einen externen Texteditor zu verfassen, abzuspeichern und dann erst hier einzustellen.
Bin auch noch beim recherchieren, wie H2O / D2O Moleküle als Quantencomputer verwendet werden könnten, ihre Beweglichkeit bei Raumtemperatur ist leider viel zu hoch,… vielleicht doch das Wasser einfrieren?. 😉
@Isaak Unger:
Ja, an Spektroskopie hatte ich auch noch gedacht gehabt, aber nicht an MRT.
Wenn man aber mal mit einfacheren Methoden an die Sache heran müsste, so könnte man vermutlich schweres Wasser von normalem Wasser durch den Auftrieb unterscheiden. So geht ja ein Schwereiswürfel in normalem Wasser unter. Ob man also mit ähnlich einfachen Methoden Schweres Wasser (D2O) von Wasser unterscheiden könnte, bei dem der Wasserstoff kein Neutron, der Sauerstoff aber zwei mehr as „normal“ hat? Oder würde man die Moleküle per Zentrifugen trennen können? Das Molekulargewicht wäre ja völlig gleich. Es wäre nur räumlich anders verteilt – mehr Masse beim Sauerstoffatom als beim schweren Wasser.